Search
一酸化炭素

一酸化炭素(いっさんかたんそ、carbon monoxide)は、炭素の酸化物の一種であり、常温・常圧で無色・無臭・可燃性の気体である。一酸化炭素中毒の原因となる。化学式は CO と表される。Carbon oxide、Carbonic oxideと表記されることもある。
性質
炭素や、それを含む有機物が燃焼すると二酸化炭素が発生するが、酸素の供給が不充分な環境で燃焼(不完全燃焼)が起こると一酸化炭素が発生する。さらに高温あるいは触媒存在下では C と CO2 とに分解(不均化)し、一酸化炭素自身も酸素の存在下で青い炎を上げて燃焼する。
高温では強い還元作用を示し、各種重金属酸化物を還元して単体金属を生成する。常温では遷移金属に配位して種々の金属カルボニルを形成する。その中のニッケルカルボニル (Ni(CO)4) は、かつてニッケル精製の中間体として用いられていた。
一酸化炭素は、二酸化炭素と異なり水にはほとんど溶けない。
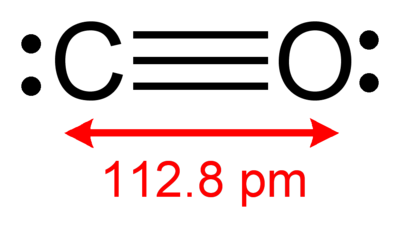
この分子は様々な点で窒素分子(N2)に似ている。分子量28.0で窒素分子とほぼ同じ。結合長は112.8 pmに対して窒素は109.8 pm。三重結合性を帯びるところも同じである。結合解離エネルギーは1072 kJ/molで窒素の942 kJ/molに近いがそれより強く、知られている最強の化学結合の一つである。これらの理由から、融点 (68 K)・沸点 (81 K)も窒素の融点 (63 K)・沸点(77 K)と近くなっている。
上のような3つの共鳴構造を持つ。だが三重結合性が強いため、電気陰性度がC<Oであるにもかかわらず、炭素原子上に負電荷が乗った一番左の構造の寄与が大きい。全体として電子は炭素原子側に偏り、双極子モーメントは0.122 Dとなる。また、σ軌道は71%、π軌道は77%酸素原子側に分極している。
基底状態は一重項状態なので不対電子はない。
製法
工業的には 800 ℃ 以上(普通は 1,000 ℃ 程度)に加熱したコークスと水(水蒸気)を反応させて作られる水性ガスから得られる。その反応は、
である。上記反応で右方向()への反応は吸熱反応であり、反応進行とともに温度が下がる。ここで排気弁を閉じ、空気を注入するとコークスが燃焼して温度が上昇するので、再び水蒸気を注入して一酸化炭素と水素を生成させる。これを繰り返してコークスがなくなったら、次のバッチを充填して反応を開始する。
実験室で作る時は、ギ酸を濃硫酸で脱水するとできる。この時、
の反応が起こる。一酸化炭素は水に溶けにくいので、水上置換で集めることができる。
また、シュウ酸を濃硫酸で脱水し、熱することでもできる。この場合、同時に発生する二酸化炭素を強塩基の水溶液で除く必要がある。
食品加工
日本では古くから、カツオやマグロなどの鮮魚として出回る魚介を一酸化炭素処理すると、刺身にした際に発色が良くなり新鮮そうに見えることが広く知られていた。
一酸化炭素がミオグロビンに結びつくとカルボキシミオグロビンになり、鮮やかな赤色を呈する。このカルボキシミオグロビンは、酸素が結びついたミオグロビンや酸化されて茶色を呈するメトミオグロビンよりもより安定した物質である。この安定した色が通常のパックよりもあたかも長持ちして新鮮なように見えることとなる。
1980年代に入ると、日本のマグロ輸入量が急増。日本発の技術として一酸化炭素の処理方法は、輸出先の国々を中心に世界的に広まることとなった。こうした処理技術は消費者が判断する鮮度の基準を狂わせ、食中毒の原因にもなりかねないことから、1994年には、食品衛生法で禁止されることとなった。しかし、世界中に広まった技術を根絶することは難しく、未だに利用する海外の業者は多いとされる。現在でも輸入加工食品の一部で一酸化炭素処理が発覚する事例がしばしば発生する。一酸化炭素処理されたマグロは「COマグロ」と呼ばれることがある。
一酸化炭素中毒
一酸化炭素中毒に罹患した場合の症状は右記の図を参照のこと。
合成化学での用途
一酸化炭素はC1化学の分野において、重要な原料化合物である。また、有機化学においてはカルボニル基の原料として、無機化学においては配位子として、一酸化炭素の応用範囲は広い。
例えば、ハロゲン化アリール(芳香族ハロゲン化物)にパラジウムなどの遷移金属触媒と求核剤を加えてクロスカップリングさせる際、一酸化炭素を共存させるとカルボニル基の挿入が起こる。
- (アルコール)+ (Pd触媒)(エステルの合成:アルコキシカルボニル化)
- + (Pd触媒) (アルデヒドの合成:ホルミル化)
アルケンに対しても、適切な触媒の作用でホルミル基 (−CHO) の付加を行うことができる。これをヒドロホルミル化、あるいはオキソ法とよび、各種アルデヒドの工業的な製法のひとつである。また、日光や触媒により塩素と反応させるとホスゲン(COCl2、工業化学上重要な化合物、かつて毒ガスとして用いられていた)が得られる。
ほか、一酸化炭素を利用する人名反応として、ガッターマン・コッホ反応 (Gattermann-Koch reaction)、コッホ・ハーフ反応 (Koch-Haaf reaction) などが知られる。
脚注
関連文献
- 村橋俊介、堀家茂樹「一酸化炭素の化学反応」『有機合成化学協会誌』第18巻第1号、有機合成化学協会、1960年、15-30頁、doi:10.5059/yukigoseikyokaishi.18.15。
関連項目
- 木炭自動車
- ガス燃料
- 北陸トンネル火災事故 - 全犠牲者30名中、29名の死因が一酸化炭素中毒だった。
- 一酸化炭素センサ
- 金属カルボニル
- カルボキシヘモグロビン( COHb ) - 一酸化炭素とヘモグロビンが結合した形態。酸素より結合度が高く異常ヘモグロビンに分類される。
- 水性ガスシフト反応
外部リンク
- 『一酸化炭素』 - コトバンク
Text submitted to CC-BY-SA license. Source: 一酸化炭素 by Wikipedia (Historical)
Owlapps.net - since 2012 - Les chouettes applications du hibou

