Search
Fluoreno

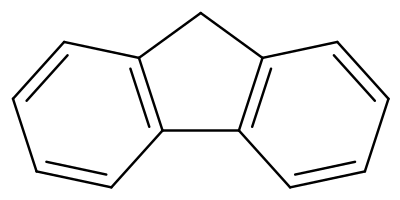
El fluoreno, o 9H-fluoreno, es un hidrocarburo aromático policíclico. Forma cristales blancos que exhiben un olor aromático característico similar al del naftaleno. Es combustible. Tiene una fluorescencia violeta, y de aquí su nombre. Para propósitos comerciales es obtenido a partir del alquitrán de hulla. Es insoluble en agua y soluble en benceno y éter etílico.
Síntesis, estructura y reactividad
Aunque el fluoreno se obtiene a partir del alquitrán de hulla, puede ser también preparado mediante la deshidrogenación del difenilmetano.[2]
La molécula de fluoreno es casi plana,[3] aunque cada uno de los dos anillos bencénicos es coplanar con el carbono central 9.[4]
Acidez
Los sitios C9-H del anillo de fluoreno son débilmente ácidos (pKa = 22.6 en DMSO.[5]) La desprotonación da el "anión" estable fluorenilo, nominalmente C13H9-, el cual es aromático y tiene un intenso color naranja. El anión es un nucleófilo, y la mayoría de los electrófilos reacciona con él adicionándose a la posición 9. La purificación del fluoreno explota su acidez y la baja solubilidad de su derivado de sodio en disolventes de hidrocarburo.
Ambos protones pueden ser removidos del C9. Por ejemplo, el 9,9-fluorenildipotasio puede ser obtenido al tratar el fluoreno con potasio metálico en dioxano hirviente.[6]
Usos
El fluoreno es un precursor para obtener otros compuestos derivados; la especie padre tiene pocas aplicaciones. El ácido fluoreno-9-carboxílico es un precursor de productos farmacéuticos. El 2-aminofluoreno, 3,6-bis-(dimetilamino)fluoreno, y el 2,7-diyodofluoreno son precursores de colorantes. La oxidación del fluoreno da fluorenona, la cual es nitrada para dar derivados comercialmente útiles. El cloruro de fluorenilmetiloxicarbonilo (cloruro de Fmoc) es usado para introducir el grupo protector carbamato de 9-fluorenilmetilo (Fmoc) en aminas en síntesis de péptidos.[2]
Los polímeros de polifluoreno, en donde el carbono 7 de una unidad está enlazado al carbono 2 del siguiente, desplazando dos hidrógenos, son conductores de la electricidad y electroluminiscentes, y han sido muy investigados para usarse como luminóforos en diodos orgánicos de emisión de luz.
Referencias
Enlaces externos
- Wikimedia Commons alberga una categoría multimedia sobre Fluoreno.
- (en inglés) Ficha en AlfaAesar
- (en inglés) Ficha de seguridad en sciencelab.com Archivado el 3 de octubre de 2018 en Wayback Machine.
- (en inglés) Ficha en GESTIS
- Fluoreno en el WebBook del NIST
- (en inglés) National Pollutant Inventory - Polycyclic aromatic hydrocarbons: Overview
Text submitted to CC-BY-SA license. Source: Fluoreno by Wikipedia (Historical)
Owlapps.net - since 2012 - Les chouettes applications du hibou